Sadržaj
- Glavna razlika
- lantanida vs aktinida
- Usporedni grafikon
- Što su lantanidi?
- Što su aktinidi?
- Ključne razlike
- Zaključak
Glavna razlika
Glavna razlika između lantanida i aktinida je u tome što su lantanidi kemijski elementi f bloka periodične tablice, koji kompleksi ne formiraju lako, dok su aktinidi oni kemijski elementi f bloka periodičke tablice, koji komplekse mogu lako formirati.
lantanida vs aktinida
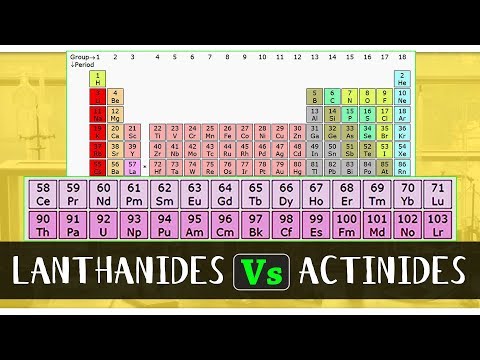
f blok elementi su elementi u koje posljednji elektron ulazi u f orbitalu svojih atoma. Ti se elementi također karakteriziraju kao elementi unutarnjeg prijelaza. Sastoje se od dvije serije koje uključuju lantanide i aktinide. Serija lantanida je niz kemijskih elemenata koji se sastoji od 15 metalnih kemijskih elemenata koji sadrže atomske brojeve od 57 do 71, od lantana do lutecija. Aktinidna serija, s druge strane, je niz kemijskih elemenata koji se sastoji od 15 metalnih kemijskih elemenata koji sadrže atomske brojeve od 89 do 103, aktinij preko Lawrencijuma.
Lantanidi se smatraju neradioaktivnim elementima osim Prometeja. Svi aktinidi s druge strane smatraju se radioaktivnim elementima zbog nestabilne prirode koju imaju.
Usporedni grafikon
| lantanida | aktinida |
| Kemijski elementi prisutni su u lantanidnoj seriji f bloka u periodičnoj tablici nazivaju se lantanidi. | Kemijski elementi koji su prisutni u nizu f aktinidnih blokova u periodičnoj tablici nazivaju se aktinidi. |
| Atomski broj | |
| Atomski broj elemenata prisutnih u seriji lantanida kreće se od 57 do 71. | Atomski broj elemenata prisutnih u seriji aktinida kreće se od 89 do 103. |
| Pozicija u periodičnoj tablici | |
| U periodnoj tablici lantanidi su smješteni u nizu lantanida f bloka. | U periodnoj tablici aktinidi su smješteni u nizu aktinidnih f blokova. |
| Oksidacijska stanja | |
| Oksidaciona stanja prikazana lantanidima su +2, +3 i +4. | Oksidaciona stanja prikazana aktinidima su +3, +4, +5 i +6. |
| Maksimalno oksidacijsko stanje | |
| Maksimalno oksidacijsko stanje koje pokazuju lantanidi je +4. | Maksimalno oksidacijsko stanje koje pokazuju aktinidi je +6. |
| Radioaktivnost | |
| Lantanidi se smatraju neradioaktivnim elementima osim Prometeja. | Svi aktinidi smatraju se radioaktivnim elementima zbog svoje nestabilne prirode. |
| Oxocations | |
| Lantanidi nisu uključeni u stvaranje oksokacija poput oksida i hidroksida. | Aktinidi su odgovorni za nastajanje oksokacija poput oksida i hidroksida. |
| Osnovno ponašanje | |
| Lanthanidi pokazuju manje osnovno ponašanje. | Aktinidi pokazuju više osnovnog ponašanja. |
| Kemijska aktivnost | |
| Lantanidi pokazuju manju tendenciju prema stvaranju kompleksa. | Aktinidi pokazuju jaču tendenciju ka stvaranju kompleksa. |
| Učinak bojanja | |
| Gotovo svi ioni koji nastaju lantanidima su bezbojni. | Većina kompleksa formiranih od aktinida su šareni. |
| Toksičnost | |
| Lantanidi nisu toksični spojevi. | Aktinidi se smatraju toksičnim spojevima zbog svog ponašanja teških metala i radioaktivnosti. |
| Valentni elektroni | |
| Valentni elektroni lantanidi smješteni su u orbiti 4f. | Valentni elektroni aktinidi smješteni su u orbiti 5f. |
Što su lantanidi?
Lantanidi su oni kemijski elementi f bloka periodične tablice, koji komplekse ne formiraju lako. Atomski broj lantanida kreće se od 57 do 71. Kako su metalni elementi, tako se oksidiraju u vlažnom zraku. Oni su također u mogućnosti da se brzo otope u kiselinama. Lantanidi mogu reagirati s kisikom i halidima, ali ta se reakcija odvija sporo. Nisu sposobni pokazati +6 oksidacijsko stanje. Zbog toga ne mogu formirati složene molekule. Lantanidi se smatraju elektropozitivnim elementima. Stoga nude prednost stvaranju molekula s elektronegativnim elementima. Ali promjene u fizikalnim i kemijskim svojstvima vrlo su manje tijekom cijele serije.
Što su aktinidi?
Aktinidi su oni kemijski elementi f bloka periodne tablice koji lako mogu formirati komplekse. Atomski broj aktinoida se kreće od 89 do 103. Najčešći i najčešći aktinidi na zemlji su torij i uran. Oni oslobađaju visoku energiju tijekom radioaktivnog raspada. Istaknuto stanje oksidacije koje pokazuju aktinidi je +3. Aktinidi čine hidrokside i osnovne okside. Oni su sposobni formirati komplekse s ligandima poput sulfata, klorida itd. Većina kompleksa formiranih od aktinida su šareni. No, aktinidi se smatraju toksičnim spojevima zbog svog ponašanja teških metala i radioaktivnosti.
Ključne razlike
- Kemijski elementi prisutni su u lantanidnom nizu f bloka u periodnoj tablici nazivaju se lantanidi, dok se kemijski elementi koji su prisutni u aktinidnom nizu f bloka u periodičnoj tablici nazivaju aktinidi.
- Atomski broj elemenata prisutnih u seriji lantanida kreće se od 57 do 71; s druge strane, atomski broj elemenata prisutnih u seriji aktinida kreće se od 89 do 103.
- U periodnoj tablici lantanidi su smješteni u nizu lantanida f bloka. Suprotno tome, u periodnoj tablici aktinidi su smješteni u nizu aktinidnih f blokova.
- Oksidaciona stanja prikazana lantanidima su +2, +3 i +4, na suprotnoj strani, oksidaciona stanja prikazana aktinidima su +3, +4, +5 i +6.
- Maksimalno oksidacijsko stanje koje pokazuju lantanidi je +4; s druge strane, maksimalno oksidacijsko stanje prikazano aktinidima je +6.
- Lantanidi se smatraju neradioaktivnim elementima osim Prometeja, dok se svi aktinidi zbog svoje nestabilne prirode smatraju radioaktivnim elementima.
- Lantanidi nisu uključeni u stvaranje oksokacija poput oksida i hidroksida; s druge strane, aktinidi sudjeluju u stvaranju oksokacija poput oksida i hidroksida.
- Lanthanidi pokazuju manje osnovno ponašanje, dok aktinidi pokazuju više osnovno ponašanje.
- Lantanidi pokazuju manju tendenciju prema stvaranju kompleksa, s one strane strane aktinidi pokazuju jaču tendenciju prema stvaranju kompleksa.
- Gotovo svi ioni koji nastaju lantanidima su bezbojni; s druge strane, većina kompleksa aktinida je šarena.
- Lantanidi nisu toksični spojevi. Suprotno tome, aktinidi se smatraju toksičnim spojevima zbog svog ponašanja teških metala i radioaktivnosti.
- Valentni elektroni lantanidi nalaze se u orbiti 4f, s druge strane valencijski elektroni aktinidi nalaze se u orbiti 5f.
Zaključak
Gornja rasprava rezimira da se lantanidi smatraju neradioaktivnim elementima i imaju neke iznimke, dok su aktinidi radioaktivni elementi. Prvi nisu mogli lako formirati komplekse, dok drugi mogu lako formirati komplekse.